Pengertian Model Atom Dalton, Rutherford, Bohr, Thomson, Ciri-ciri, Kelebihan dan Kelemahan. Sobat Zonakeren.com, kali ini kita akan bersama-sama mempelajari berbagai keunggulan dan kekurangan teori atom yang dikemukakan oleh para ahli.
Mungkin sobat sering mendengar mengenai kata atom dan juga teori atau model atom ketika sedang mendengarkan materi pelajaran dari Bapak dan Ibu Guru di sekolah. Namun apakah sobat sudah benar-benar paham tentang apa yang sudah disampaikan oleh Bapak dan Ibu Guru?
Teori atom yang akan kita bahas ini meliputi model atom Rutherford, Dalton, Niels Bohr dan Josep John Thomson. Langsung saja sobat bisa membacanya satu per satu teori model atom berikut ini. Namun sebelum kita melangkah lebih jauh dalam membahas model atom, ada baiknya jika kita pelajari sejenak apa pengertian atom itu? Bagaimana sejarah atom dan hal-hal yang terkait dengan atom itu sendiri.
Pengertian Atom
Atom adalah suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri atas proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak memiliki neutron). Elektron-elektron pada sebuah atom terikat pada inti atom oleh gaya elektromagnetik. Sekumpulan atom demikian pula dapat berikatan satu sama lainnya, dan membentuk sebuah molekul. Atom yang mengandung jumlah proton dan elektron yang sama bersifat netral, sedangkan yang mengandung jumlah proton dan elektron yang berbeda bersifat positif atau negatif dan disebut sebagai ion. Atom dikelompokkan berdasarkan jumlah proton dan neutron yang terdapat pada inti atom tersebut. Jumlah proton pada atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
Istilah atom berasal dari Bahasa Yunani (ἄτομος/átomos, α-τεμνω), yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani. Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa ‘atom’ tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan kemudian berhasil memodelkan atom.
Dalam pengamatan sehari-hari, secara relatif atom dianggap sebuah objek yang sangat kecil yang memiliki massa yang secara proporsional kecil pula. Atom hanya dapat dipantau dengan menggunakan peralatan khusus seperti mikroskop gaya atom. Lebih dari 99,9% massa atom berpusat pada inti atom, dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan inti yang tidak stabil, yang dapat mengalami peluruhan radioaktif. Hal ini dapat mengakibatkan transmutasi, yang mengubah jumlah proton dan neutron pada inti. Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur, dan memengaruhi sifat-sifat magnetis atom tersebut.
Setelah sobat ZOKER mengetahui definisi atom, maka mari kita lanjutkan pembahasan model atom pada hari ini.
Sejarah Penemuan Atom
Dalam sejarah diperkirakan penemuan atom ditemukan ditahun 1803 oleh John Dalton yang pada saat itu mengemukakan sebuah teori tentang atom. Selanjutnya, banyak ilmuwan yang mendukung teori atom yang dilakukan oleh John Dalton seperti, Michael Faraday seorang yang telah menemukan teori pemecahan molekul menggunakan elektrolisis pada tahun 1832, dan J.Plucker yang menemukan tabung katoda pada tahun 1839.
Kemudian diikuti dengan penemuan oleh Dmitri Mendelev mengenai hukum periodic pada tahun 1869. John C.Maxwell tahun 1873 yang melakukan penelitian tentang listrik dan medan listrik.
Lalu ada Sir Willian Crookes pada tahun 1870 melalui penelitian eksperimental menemukan suatu electron memiliki massa tertentu melalui percobaan penembakan sinar katoda.
Lalu penelitian yang telah dilalui oleh E.Goldstein, beliau menemukan proton yang bermuatan positif.Kemudian berlanjut pada G.J Stoney yang berhasil menemukan partikel penyusun atom bermuatan negative yaitu electron. Dan penelitian oleh Wilhelm Roentgen yang menemukan X-Ray.
Rutherford kemudian membuat hipotesis berdasarkan penelitiannya yang mengemukakan bahwa terdapat suatu inti atom selain proton yang menjaga keseimbangan atom.
Hipotesis Rutherford tersebut kemudian dibuktikan oleh James Chadwik tahun 1932 dengan menemukan partikel atom yang bermuatan netral yang disebut dengan neutron.
Partikel Dasar Atom
Dalam terdapat suatu partikel yang merupakan dasar atom dan terdiri dari proton, neutron dan elektron. Partikel dasar ini tidak terlepas dari adanya pengaruh gaya elektromagnetik yang mengikat partikel-pertikel ini. Adapun pengertian dari proton, neutron, dan elektron dapat sobat lihat di bawah ini.
Proton
Proton adalah partikel dasar yang mempunyai suatu muatan positif (+1) dan mempunai diameter yang hanya 1/3 diameter electron. Namun, proton memiliki massa sekitar 1840 kali electron.
Neutron
Neutron ialah merupakan suatu partikel dasar yang tidak mempunyai sebuah muatan (netral), dan mempunyai massa yang sama dengan gabungan antara massa proton dan massa electron.
Elektron
Elektron ialah masih termasuk partikel dasar yang mempunyai tapi bermuatan negative (-1) dan memiliki massa paling ringan diantara partikel lainnya yang hanya 1/1840 kali massa proton atau neutron.
Partikel-partikel Atom
Bagaimana sobat, masih ingin lanjut? Hmm.., Di bawah ini merupakan partikel-artikel atom, yaitu :
Partikel Subatom
Walaupun dalam definisi atom menerangkan bahwa atom merupakan suatu bagian terkecil dari material yang tidak dapat dibagi lagi, namun dalam ilmu modern, atom sendiri tersusun dari beberapa partikel subatom. Partikel subatom tersebut meliputi proton, elektron dan neutron.
Inti Atom
Inti atom terdiri atas proton dan neutron yang terikat di inti atom oleh suatu gaya elektromagnetik. Proton dan nutron ini disebut nucleon atau penyusun inti.
Inti atom memuyai diameter sekitar 10-15 nm. dari sudut unsur kimia atom mempunyai kimia dan jumlah proton yang sama . Suatu unsur bisa mempunyai variasi jumlah neutron yang disebut isotop.
Awan Elektron
Awan partikel adalah suatu daerah dalam sumur potensi dimana tiap-tiap electron menghasilkan sejenis gelombang diam (gelombang yang tidak bergerak).
Sifat-Sifat Atom
Berikut ini adalah sifat-sifat atom yang meliputi:
Sifat Nuklir
Sifat yang dimiliki oleh unsur-unsur atom yang mempunyai nomor atom lebih dari 82 ialah nuklir atau radioaktif . Dari sekitar 339 nuklida yang telah ditemukan secar alami di bumi, sebanyak 269 diantaranya belum terpantau secara menyeluruh.
Pada unsur kima, 80 dari unsur yang diketahui memiliki satu atau lebih isotope stabil. Unsur 43, 63, dan semu aunsur yang memiliki nomor atom lebih dari 82 tidak mempunyai isotope stabil. Hal ini yang menyebabkan unsur tersebut memiliki sifat radioaktif.
Massa Atom
Jumlah keseluruhan dari partikel dasar dalam suatu atom disebut nomor massa. Massa atom ialah merupakan suatu yang dalam keadaan diam dinilai dengan menggunakan satuan Dalton. Massa atom dalam unsur yang berbeda mempunyai massa yang bervariasi.
Nomor Atom
Apabila jumlah proton tidak sama dalam intinya itu merupakan Atom-atom yang ada didalam zat yang berbeda . Jumlah proton dalam inti ini disebut nomor atom.
Gaya Atom
Untuk menjaga elektron yang bermuatan negatif merupakan fungsi dari gaya elektromagnetik yang bertujuan agar tetap berada orbit sekeliling inti muatan positif.
Model Atom Dalton

Teori Model Atom Dalton adalah suatu teori ini yang dikemukakan oleh John Dalton ditahun 1803, bahwa ia berpendapat berdasarkan dua hukum yang diambil, yaitu hukum kekekalan massa (Lavoisier) dan hukum susunan tetap (hukum Prouts).
Lavosier menjelaskan dalam hukum kekekalan massa bahwa “massa total zat-zat sebelum reaksi sama dengan massa total zat-zat hasil reaksi”. Begitu juga dengan hukum susunan tetap.
Sementara itu, Prouts menyatakan bahwa “perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum tersebut, maka Dalton menarik kesimpulannya yaitu:
- Jenis atom merupakan suatu bagian terkecil dalam materi yang tidak dapat dibagi lagi
- Atom berbentuk mirip seperti bola pejal yang snagat kecil, suatu atom memiliki unsur-unsur memiliki atom-atom yang identikdan berbeda dengan unsur yang berbeda
- Atom-atom yang apabila bergabung akibatnya akan membentuk sebuah senyawa dengan perbandingan suatu bilangan bulat dan sederhana.
- Reaksi kimia mempunyai fungsi untuk pemisahan dan penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Teori atom dalton tersebut memiliki satu kelemahan, yaitu tidak bisa menjelaskan bagaimana suatu materi dapat menghantarkan listrik. Bagaimana mungkin sebuah bola pejal menghantarkan listrik, sebab listrik itu dihantarkan oleh electron yang bergerak.
Kelebihan Model Atom Dalton
Pada teori atom dalton menjadi suatu teori yang sangat penting sehingga membuat ilmuan lain tertarik untuk mempelajari atom secara mendalam, sehingga terdapat model-model atom yang lebih kompleks.
Kelemahan Model Atom Dalton
- Atom digambarkan sebagai bola pejal yang kecil
- Atom merupakan suatu partikel kecil yang tidak bisa dibagi lagi
- Atom merupakan suatu unsur yang mempunyai sifat yang sama
- Apabila atom digabungkan maka akan membentuk atom yang senyawa
- Reaksi kimia merupakan reoganisasi dari sejumlah atom, sehingga tidak ada atom yang berubah akibat reaksi kimia
Ciri-ciri Model Atom Dalton
Berikut ini adalah ciri-ciri model atom dalton:
- Jenis atom ialah yang merupakan suatu bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
- Suatu unsur mempunyai atom-atom yang identik dan berbeda untuk unsur yang berbeda, atom dapat digambarkan menjadi bola pejal yang sangat kecil
- Dengan perbandingan bilangan bulat dan sederhana atom bergabung membentuk senyawa. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
- Pada Reaksi kimia dapat disebut juga suatu pemisahan dan penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Model Atom Rutherford

Teori atom Rutherford didasarkan pada percobaan yang membakar inti atom pelat emas dengan partikel alfa, yang dikenal sebagai eksperimen Geiger-Marsden. Pada saat itu, Rutherford menyusun desain untuk desain eksperimental penembakan atom emas oleh partikel alfa yang dipancarkan oleh unsur radioaktif. Rupanya ada sinar radioaktif yang dipantulkan, dibelokkan dan ditransmisikan. Pertimbangkan gambar uji Rutherford berikut:
Eksperimen tentang pembakaran inti pelat emas dengan partikel alfa yang dikenal sebagai eksperimen Geiger-Marsden. Rutherford menjelaskan bahwa jika partikel alfa mengenai inti, akan terjadi tabrakan yang akan mengarah pada pembengkokan atau refleksi partikel alfa.
Hal ini disebabkan massa dan muatan atom terkonsentrasi di nukleus. Rutherford mengasumsikan bahwa muatan inti atom sebanding dengan massa atom dalam satuan massa atom. Partikel alfa yang mengenai awan elektron tidak dibelokkan atau dipantulkan.
Bunyi Teori Atom Rutherford
Rutherford memeriksa hamburan sinar λ (alpha) di piring emas. Hasil pengamatan ini dikembangkan dalam model hipotesis atom Rutherford:
- Elektron bergerak di sekitar nukleus dengan kecepatan sangat tinggi.
- Atom memiliki inti bermuatan positif yang membentuk pusat massa atom.
- Sebagian besar partikel λ lewat tanpa dibelokkan. Sebagian kecil dibelokkan dan tercermin sangat sedikit.
- Sebagian besar atom adalah permukaan kosong atau hampa.
- Awan elektron tidak mempengaruhi dispersi partikel alfa.
Sejarah Model Atom Rutherford
Awalnya Rutherford dengan dua muridnya (Hans Geiger dan Erners Masreden) melakukan sebuah percobaan yang dikenal dengan hamburan sinar alfa (λ) terhadap lempeng tipis emas. Dari semua hasil penelitiannya ditemukan bahwa sebagian besar partikel alfa mampu menembus lembaran emas tanpa dibelokkan.
Bersamaan dengan itu, Rutherford juga menemukan partikel alfa yang dibelokkan sedikit, namun dengan sangat mengejutkan, Rutherford juga menemukan beberapa partikel alfa yang dibelokkan pada sudut yang sangat tajam kembali ke sumber radioaktif. Rutherford kemudian mengembangkan model inti atom.
Rutherford membuat kesimpulan bahwa:
- Karena hampir semua partikel alfa diteruskan maka atom bukan merupakan bola pejal.
- Jika lempeng emas tersebut dianggap sebagai satu lapisanatom-atom emas, maka d idalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif.
- Dengan didasari sebuah fakta yang menegaskan bahwa 1 dari 20.000 partikel alfa akan dibelokkan. Apa angka tersebut merupakan suatu perbandingan diameter, maka didapatkan ukuran inti atom kira-kira 10.000 lebih kecil daripada ukuran atom keseluruhan.
Berdasarkan kesimpulan dari hasil pengamatannya Rutherford mengemukan sebuah model atom yang dikenal dengan model atom Ruthreford yaitu ” Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif.”
Ciri-ciri Teori Atom Rutherford
- Permukaan kosong atau hampa merupakan bentuk atom.
- Dengan bermuatan positif dan termasuk pusat massa atom ialah disebut inti atom.
- Dengan kecepatan yang sangat tinggi elektron bergerak mengelilingi inti.
- Sebagian kecil dibelokkan, dan sedikit sekali yang dipantulkan.
- Awan elektron tidak mempengaruhi penyebaran partikel λ (alfa).
Kelebihan Model Atom Rutherford
- Mudah dipahami untuk menjelaskan struktur atom yang rumit
- Dengan inti atom yang berputar mengelilingi maka dapat menjelaskan bentuk lintasan elektron
- Dapat menggambarkan gerak elektron disekitar inti
Kelemahan Model Atom Rutherford
- Bersumber dari para pakar hukum fisika klasik, pada elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik.
- Dalam penjelasan model atom rutherford ia tidak dapat menerangkan dimana letak elektron dan cara rotasinya terhadap inti atom.
- Ketika energi atom menjadi tidak stabil itu diakibatkan oleh elektron memancarkan energi ketika bergerak,
- Tidak mempunyai kemampuan untuk menjelaskan spektrum garis pada atom hidrogen (H).
Model Atom Bohr

Dilihat dari kandungan energi elektron, ternyata model atom Rutherford mempunyai kelemahan. Ketika elektron-elektron mengelilingi inti atom, mereka mengalami percepatan terus-menerus, sehingga elektron harus membebaskan energi. Lama kelamaan energi yang dimiliki oleh elektron makin berkurang dan elektron akan tertarik makin dekat ke arah inti, sehingga akhirnya jatuh ke dalam inti. Tetapi pada kenyataannya, seluruh elektron dalam atom tidak pernah jatuh ke inti. Jadi, model atom nuklir Rutherford harus disempurnakan.
Dua tahun berikutnya, yaitu pada tahun 1913, seorang ilmuwan dari Denmark yang bernama Niels Henrik David Bohr (1885-1962) menyempurnakan model atom Rutherford. Bohr mengemukakan teori tentang atom yang bertitik tolak dari model atom nuklir Rutherford dan teori kuantum Planck.
Model atom yang diajukan Bohr dikenal sebagai model atom Rutherford-Bohr, yang dapat diterangkan sebagai berikut.
1. Elektron-elektron dalam atom hanya dapat melintasi lintasan-lintasan tertentu yang disebut kulit-kulit atau tingkat-tingkat energi.
2. Elektron yang beredar pada lintasannya tidak memancarkan energi, lintasan elektron ini disebut lintasan / keadaan stasioner.
3. Kedudukan elektron dalam kulit-kulit, tingkat-tingkat energi dapat disamakan dengan kedudukan seseorang yang berada pada anak-anak tangga. Seseorang hanya dapat berada pada anak tangga pertama, kedua, ketiga, dan seterusnya, tetapi ia tidak mungkin berada di antara anak tangga-anak tangga tersebut.
Apabila elektron dengan tingkat energi rendah pindah ke lintasan dengan tingkat energi lebih tinggi maka elektron akan menyerap energi, peristiwa ini disebut eksitasi. Sebaliknya, apabila elektron pindah dari lintasan dengan tingkat energi lebih tinggi ke lintasan dengan tingkat energi lebih rendah maka elektron akan memancarkan energi, peristiwa ini disebut deeksitasi. Baik eksitasi maupun deeksitasi disebut peristiwa transisi elektron. Energi yang diserap atau dipancarkan pada peristiwa transisi elektron ini dinyatakan dengan persamaan:
ΔE = hv
Keterangan:
ΔE = perbedaan tingkat energi
h = tetapan Planck = 6,6 × 10–34 J/s
v = frekuensi radiasi4. Energi yang dipancarkan/diserap ketika terjadi transisi elektron terekam sebagai spektrum atom.
Model atom Bohr tersebut dapat dianalogkan seperti sebuah tata surya mini. Pada tata surya, planet-planet beredar mengelilingi matahari. Pada atom, elektron-elektron beredar mengelilingi atom, hanya bedanya pada sistem tata surya, setiap lintasan (orbit) hanya ditempati 1 planet, sedangkan pada atom setiap lintasan (kulit) dapat ditempati lebih dari 1 elektron.
Dalam model atom Bohr ini dikenal istilah konfigurasi elektron, yaitu susunan elektron pada masing-masing kulit. Data yang digunakan untuk menuliskan konfigurasi elektron adalah nomor atom suatu unsur, di mana nomor atom unsur menyatakan jumlah elektron dalam atom unsur tersebut. Sedangkan elektron pada kulit terluar dikenal dengan sebutan elektron valensi. Susunan elektron valensi sangat menentukan sifatsifat kimia suatu atom dan berperan penting dalam membentuk ikatan dengan atom lain.
Untuk menentukan konfigurasi elektron suatu unsur, ada beberapa patokan yang harus selalu diingat, yaitu:
- Dimulai dari lintasan yang terdekat dengan inti, masing-masing lintasan disebut kulit ke-1 (kulit K), kulit ke-2 (kulit L), kulit ke-3 (kulit M), kulit ke-4 (kulit N), dan seterusnya.
- Jumlah elektron maksimum (paling banyak) yang dapat menempati masing-masing kulit adalah: 2 n2, dengan n = nomor kulit. Kulit K dapat menampung maksimal 2 elektron. Kulit L dapat menampung maksimal 8 elektron. Kulit M dapat menampung maksimal 18 elektron, dan seterusnya.
- Kulit yang paling luar hanya boleh mengandung maksimal 8 elektron.
Kelebihan Model Atom Bohr
- Menjawab kelemahan dalam model atom Rutherford dengan mengaplikasikan teori kuantum.
- Menerangkan dengan jelas garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom hidrogen.
Kelemahan Model Atom Bohr
- Terjadi penyimpangan untuk atom yang lebih besar dari hidrogen.
- Tidak dapat menerangkan efek Zaeman, yaitu spektrum atom yang lebih rumit apabila atom ditempatkan pada medan magnet.
Model Atom Thomson
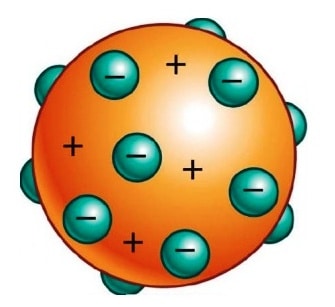
Model teori atom Thomson ini muncul setelah dikemukakannya sebuah teori Dalton di tahun 1903. Teori atom Thomson merupakan salah satu teori yang menjelaskan bentuk atom ialah seperti bentuk roti kismis. Ia mengibaratkan atom tersebut seperti roti kismis, bahwa atom yang bermuatan positif tersebut bertaburan dengan atom yang bermuatan negatif terdapat di sekelilingnya.
Sampai dengan akhir abad ke 19, teori atom ini masih dipercaya seperti bentuk bola pejal bola billyard. Sedangkan pada tahun 1987 Josep John Thomson kemudian mengemukakan sebuah teori atom dengan adanya penemuan elektron yang kemudian sering dikenal sebagai teori atom J.J. Tomson.
Bunyi Teori Atom Thomson
Atom ini merupakan sebuah bola yang memiliki muatan positif dengan adanya elektron bermuatan negatif yang berada disekitarnya. Muatan positif atau juga negatif pada atom itu besarnya sama. Hal tersebut menunjukan atom bermuatan netral. Suatu atom tidak memiliki muatan positif serta muatan negatif yang berlebihan.
Selain disebut sebagai teori roti kismis, teori atom J.J. Thomson ini juga sering disebut sebagai teori atom yang hampir mirip semangka. Dengan penjelasan bahwa daging semangka ini merupakan sebuah area yang bermuatan positif sedangkan bijinya tersebut merupakan elektron yang bermuatan negatif.
Penemuan elektron oleh J.J. Thomson pada saat sedang melakukan suatu percobaan dengan tabung sinar katoda. Di saat itu, J.J. Thomson tersebut melihat bahwa jika arus listrik akan melewati tabung vakum, terdapat semacam aliran berkilau yang terbentuk. Thomson yang menemukan bahwa aliran itu dibelokkan ke arah plat kutub positif. Teori atom J.J. Thomson tersebut membuktikan bahwa aliran tersebut terbentuk dari partikel kecil dari atom serta juga partikel tersebut bermuatan negatif,lalu J.J. Thomson kemudian menamakannya dengan elektron.
Pelucutan Gas
Pelucutan gas peristiwa tersebut mengalirnya muatan-muatan listrik di dalam tabung lucutan gas pada tekanan yang sangat kecil. Sebuah tabung lucutan tersebut merupakan sebuah tabung yang berisi udara, didalam tabung tersebut berisi elektrode-elektrode, yang biasanya sering disebut dengan anoda atau katode. Udara di dalam tabung tersebut tidak dapat mengalirkan arus listrik walaupun ujung-ujung elektroda itu dihubungkan dengan induktor Ruhmkorf.
Katoda (-) Anoda (+)
Keadaan tersebut akan berubah apabila udara dalam tabung dikeluarkan sehingga tekanan udara tersebut semakin kecil dan letak-letak molekul udara juga manjadi sangat renggang. Pada tekanan 4 cm Hg dalam tabung tersebut memancarkan sinar cahaya merah-ungu. Cahaya tersebut bisa saja menghilang sejalan dengan semakin kecilnya suatu tekanan. Pada tekanan 0,02 mm Hg udara di dalam tabung itu tidak lagi memancarkan sebuah cahaya namun kaca dimuka katoda ini akan berpendar kehijauan.
Crookes juga berpendapat bahwa dari katoda tersebut dipancarkan sinar yang tidak tampak yang sering disebut dengan Sinar katoda. Sinar katoda ini juga dapat di pelajari karena yang memiliki sifat memendarkan kaca. Sinar Katoda ini merupakan sebuah arus elektron dengan kecepatan tinggi yang keluar dari katoda. Adapun sifat sifat Sinar Katoda antara lain:
- Mempunyai Energi
- Memendarkan kaca
- Membelok dalam medan listrik dan juga medan magnet.
- Jika ditembakkan pada logam akan menghasilkan sinar X.
Kelebihan Model Atom Thomson
Kelebihan dari teori atom Thomson ini dapat membuktikan adanya partikel lain yang memiliki muatan negatif dalam atom. Berarti atom tersebut bukan merupakan bagian yang terkecil dari suatu unsur.
Kelemahan Model Atom Thomson
- Tidak bisa menentukan gerakan elektron di dalam atom
- Tidak dapat menentukan massa elektron.
Kesimpulan Teori Model Atom Menurut Para Ilmuwan
1. Teori Atom Dalton
Model Atom: Menurut Dalton seperti bola pejal.
Kelebihan: Mulai membangkitkan minat terhadap penelitian mengenai model atom.
Kelemahan: Tidak menerangkan hubungan antara larutan senyawa dan daya hantar arus listrik, jika atom merupakan bagian terkecil dari suatu unsur dan tidak dapat dibagi lagi.
2. Teori Atom Rutherford
Model Atom: Menurut Rutherford seperti planet bumi mengelilingi matahari.
Kelebihan:
Membuat hipotesis bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti dan satu sama lain terpisah oleh ruang hampa.
Kelemahan:
Model tersebut tidak dapat menerangkan mengapa elektron tidak pernah jatuh ke dalam inti sesuai dengan teori fisika klasik.
3. Teori Atom Bohr
Model Atom: Menurut Niels Bohr seperti bola, dengan inti atom yang dikeliling, sejumlah elektron.
Kelebihan:
Mampu membuktikan adanya lintasan elektron untuk atom hidrogen dengan jari-jari bola:
= 0,529 Angstrom
= 0,529 x 10–10 m
= 1 bohr
Bohr-sommerfeld mengembangkan orbit Bohr (bola) menjadi orbital yaitu fungsi gelombang elektron atau identitas elektron sebagai gelombang yang memiliki bentuk bola (l = 0, orbital s) atau 1 bola, (l = 1, orbital p) atau 2 balon terpilin, (l = 2, orbital d) atau 3 balon terpilin, (l = 3, orbital f).
Kelemahan: Hanya dapat menerangkan atom-atom yang memiliki elektron tunggal seperti gas hidrogen, tetapi tidak dapat menerangkan spektrum warna dari atom-atom yang memiliki banyak elektron.
4. Teori Atom J.J. Thomson
Model Atom: Menurut JJ Thomson seperti roti kismis.
Kelebihan: Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur. Selain itu juga memastikan bahwa atom tersusun dari partikel yang bermuatan positif dan negatif untuk membentuk atom netral. Juga membuktikan bahwa elektron terdapat dalam semua unsur.
Kelemahan: Belum dapat menerangkan bagaimana susunan muatan positif dan jumlah elektron dalam bola.
 ZONAKEREN.COM Tempatnya Informasi Keren
ZONAKEREN.COM Tempatnya Informasi Keren